1. Definición
La Química Orgánica o Química del Carbono, es la rama de la Química que estudia la estructura, propiedades, síntesis y reactividad de aquellos compuestos químicos que son la piedra fundamental de toda la vida en el planeta y que están formados principalmente por Carbono (C), Hidrógeno (H) así como Oxígeno (O), Nitrógeno (N), Azufre (S) y Halógenos en pequeñas cantidades.
El término
"orgánico" se debe al hecho de que estos compuestos forman parte de
los procesos vitales. Su estudio nos ayuda a comprender el comportamiento y
características de los compuestos biológicos.
Por medio de la Química Orgánica se han podido sintetizar infinidad de
compuestos que nos han proporcionado una vida más cómoda y placentera como son:
plásticos, detergentes, pinturas, explosivos, productos farmacéuticos,
colorantes, insecticidad, etc.
2. El carbono en la naturaleza
El carbono es un elemento no metálico que se presenta en formas muy variadas. Puede aparecer combinado, formando una gran cantidad de compuestos, o libre (sin enlazarse con otros elementos).
A. Combinado
- En la atmósfera: en forma de dióxido de carbono CO2
- En la corteza terrestre: formando carbonatos, como la caliza CaCO3
- En el interior de la corteza terrestre: en el petróleo, carbón y gas natural.
- En la materia viva animal y vegetal: es el componente esencial y forma parte de compuestos muy diversos: glúcidos, lípidos, proteínas y ácidos nucleicos.
- En el cuerpo humano, por ejemplo, llega a representar el 18% de su masa.
B. Libre
 Diamante
Diamante
Variedad
de carbono que se encuentra en forma de cristales transparentes de gran dureza.
|
Grafito
Es una sustancia negra, brillante, blanda y untosa al tacto. Se
presenta en escamas o láminas cristalinas ligeramente adheridas entre si, que pueden
resbalar unas sobre otras.
Los
átomos de carbono se disponen en láminas planas formando hexágonos. Cada átomo
está unido a otros tres por medio de enlaces covalentes. El
cuarto electrón se sitúa entre las láminas y posee movilidad. Por esto el grafito
es fácilmente exfoliable y un excelente conductor del calor y la electricidad.
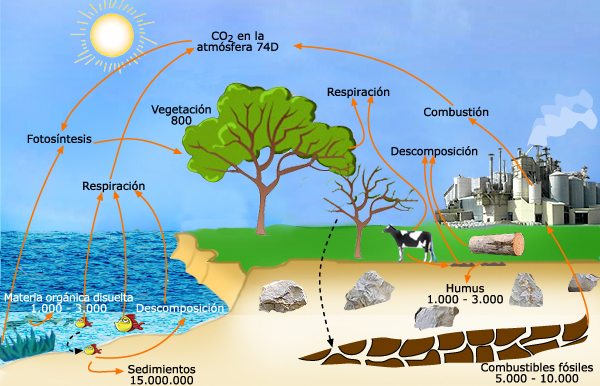
3. El ciclo del carbono
Conjunto de procesos mediante los cuales se realiza el intercambio del carbono entre los seres vivos y el medio que les rodea.
Los vegetales toman el carbono a partir del dióxido de carbono, CO2, presente en la atmósfera. Mediante la fotosíntesis fabrican su propia materia orgánica.
Los
animales que se alimentan de los vegetales o de otros animales (nutrición
heterótrofa), transforman después la materia viva de estos seres vivos en
su propia materia viva.
Cuando
los vegetales y los animales mueren, la descomposición de materia
orgánica produce también dióxido de carbono.
En
algunas ocasiones, los restos de los seres vivos se fosilizan y se
transforman, al cabo de millones de años, en carbón o petróleo.
La
respiración de animales y vegetales libera nuevamente dióxido de
carbono que vuelve a la atmósfera. La
combustión de carbono y petróleo
también restituye el dióxido de carbono a la atmósfera.
4. Características de los compuestos del carbono.
5. El átomo de carbono
Siendo el átomo de carbono la base estructural de los compuestos orgánicos, es conveniente señalar algunas de sus características.
Los
compuestos que forma el carbono son numerosísimos. Se calcula que superan los
tres millones y cada año se descubren o sintetizan unos cien mil más.
Esta
extraordinaria capacidad de combinación se debe a su estructura
electrónica, a que dispone
de cuatro electrones en su nivel más externo, con lo que puede formar cuatro
enlaces covalentes y que puede
establecer enlaces con otros elementos, o bien entre átomos de carbono.
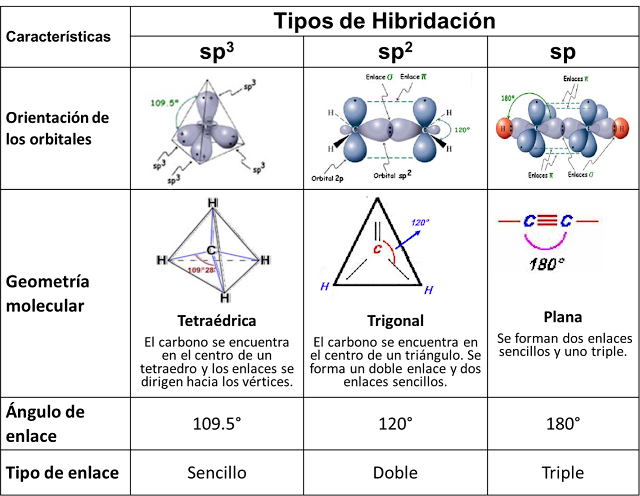
5.1 Hibridación
La hibridación es un fenómeno que consiste en la mezcla de orbítales atómicos puros para generar un conjunto de orbítales híbridos, los cuales tienen características combinadas de los orbítales originales.
Hibridación sp3
Estos orbítales son idénticos entre si, pero diferentes de los originales ya que tienen características de los orbítales “s” y “p”.combinadas. Estos son los electrones que se comparten. En este tipo de hibridación se forman cuatro enlaces sencillos.
.
Hibridación sp2
En este tipo de hibridación se combinan solo dos orbítales “p” con un orbital “s” formándose tres orbítales híbridos sp2. El átomo de carbono forma un enlace doble y dos sencillos.
Hibridación sp
En este tipo de hibridación sólo se combina un orbital “p” con el orbital “s”. Con este tipo de hibridación el carbono puede formar un triple enlace.
5.2 Geometría molecular
El tipo de hibridación determina la geometría molecular la cual se resume en el siguiente cuadro.
5.3 Tipos de isomería
Los compuestos del carbono presentan diversos tipos de isomería. Consulta el enlace para ver los diversos Tipos de Isomería.